
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
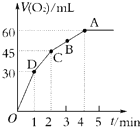 加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
加入0.1mol MnO2粉末于50mL过氧化氢溶液(H2O2,ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.| 3 |
| 4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
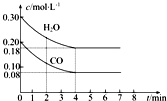 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:| C.(I-)/mol?L-1 | C.(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com