某校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/)配制成1000mL 0.lmol?L
-1的盐酸溶液.
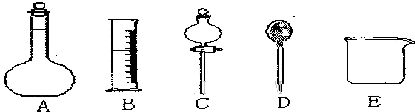
(1)在如图所示仪器中,配制上述溶液不需要的仪器是
(填上图相应仪器名称):
除图中已有仪器外,配制上述溶液还需要的玻璃仪器是
,其作用按使用的先后顺序分别是
和
.
(2)根据计算,需要量取浓盐酸的体积为
mL,本实验量筒应使用的是
(在横线上填写相应的序号)
A.l0mL B.l00mL C.250mL D.500mL
(3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)
①待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中.
②往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切.
③在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
(4)容量瓶在使用前必须
.
(5)若定容后摇匀静置,发现凹液面低于刻度线,此时应该
A.直接转移到细口试剂瓶中 B.再用胶头滴管加水,重新定容
C.将此溶液倒掉,重新配制 D.直接贮存于容量瓶中
(6)假设配制时其他操作均正确,只出现以下某-情况,试判断所配制的溶液浓度相比于要求的值(即0.1mol/L)如何.(a、偏高;b、偏低:c、无影响,在下列横线上填相应序号)
①容量瓶中有少量蒸馏水
②烧杯和玻棒没有洗涤2-3次
③稀释浓HCI时,没有冷却就立即转移到容量瓶中
④配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中
⑤若定容时俯视,所配溶液的物质的量浓度
.


