
科目: 来源: 题型:
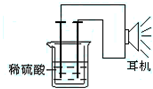 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:查看答案和解析>>
科目: 来源: 题型:
 一定温度下,向某容器固定的密闭容器中加入适量(NH4)2S固体,发生如下反应:
一定温度下,向某容器固定的密闭容器中加入适量(NH4)2S固体,发生如下反应:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
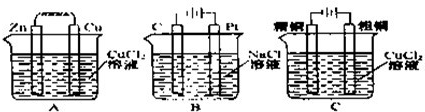
查看答案和解析>>
科目: 来源: 题型:
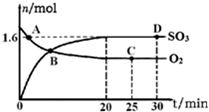 硫的化合物在生产和科研中发挥着重要作用.
硫的化合物在生产和科研中发挥着重要作用.查看答案和解析>>
科目: 来源: 题型:
| 溶液中检测出的溶质 | |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2CO3、NaCl |
| 第三次 | KCl、K2CO3、Na2SO4、NaCl |
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 |
| 第一步 | 向溶液中滴加过量的硝酸 | 检验① |
② |
| 第二步 | 继续滴加过量的 ③ |
检验SO42-的存在 | ④ |
| 第三步 | 过滤,再向滤液中滴加 ⑤ |
检验 ⑥ |
Ag++Cl-=AgCl↓ |
查看答案和解析>>
科目: 来源: 题型:
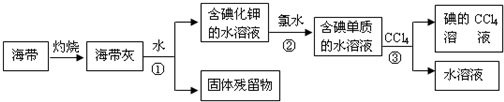
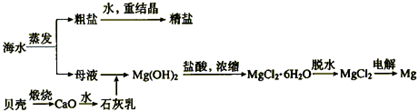
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com