
科目: 来源: 题型:
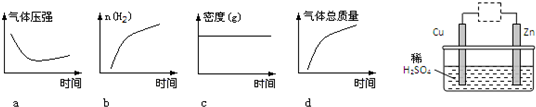
查看答案和解析>>
科目: 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
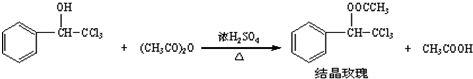
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-.取该溶液进行如下实验:
某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-.取该溶液进行如下实验:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| W | X | Y | Z | |
| 结构 或 性质 |
最高价氧化物是温室气 体,其原子的最外层电子 数是次外层电子数的2 倍 |
最高价氧化物对 应的水化物与其 气态氢化物反应 得到离子化合物 |
氧化物是常见的两性化合物 | 最高正价与最 低负价之和为 零 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 催化剂 |
| n(H2) |
| n(CO2) |
| 1 |
| 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com