
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
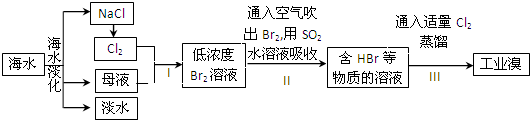
查看答案和解析>>
科目: 来源: 题型:
| 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
查看答案和解析>>
科目: 来源: 题型:
| 周期 族 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | |||||
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

| SaSO4 | BaSO4 | Sr(OH)2 | |
| Ksp | 3.3×10-7 | 1.1×10-10 | 3.2×10-4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、肯定有一种元素被氧化,另外一种或多种元素被还原 |
| B、某元素从化合态变成游离态,该元素一定被还原 |
| C、氧化还原反应的本质是元素的化合价发生改变 |
| D、在反应中不一定所有元素的化合价都发生变化 |
查看答案和解析>>
科目: 来源: 题型:
| A、根据化合物在水溶液或熔融状态下是否导电,将化合物分为电解质和非电解质 |
| B、氨气的水溶液能够导电,因此NH3是电解质 |
| C、电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关 |
| D、溶液与胶体的本质区别是分散质颗粒直径大小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com