
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
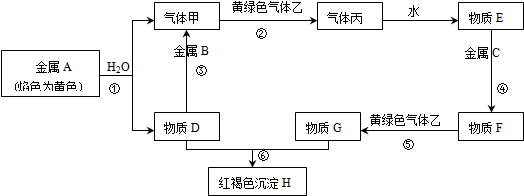
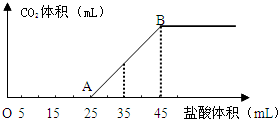 将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况下测定)关系如图所示:
将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况下测定)关系如图所示:查看答案和解析>>
科目: 来源: 题型:
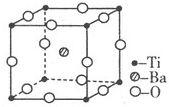 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:48 22 |
50 22 |
查看答案和解析>>
科目: 来源: 题型:
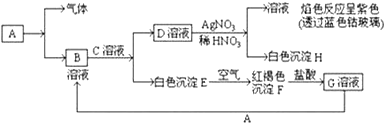
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
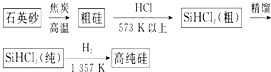
查看答案和解析>>
科目: 来源: 题型:
| 元素代号 | A | B | C |
| 第一电离能(kJ?mol-1) | 520 | 496 | 419 |
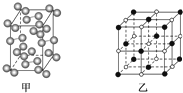
查看答案和解析>>
科目: 来源: 题型:
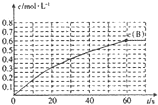 298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g);
298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g);| 1 |
| 6 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 化学反应 | 平衡 常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g) CO2(g)+H2(g) | K3 | ? | ? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com