
科目: 来源: 题型:
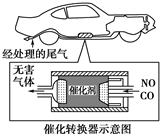 现有中学化学中常见的几种物质:①O2、②Mg、③CO、④WO3、⑤W、⑥CO2.
现有中学化学中常见的几种物质:①O2、②Mg、③CO、④WO3、⑤W、⑥CO2.
| ||
查看答案和解析>>
科目: 来源: 题型:
| C |
| D |
查看答案和解析>>
科目: 来源: 题型:
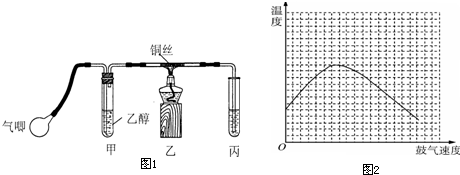
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
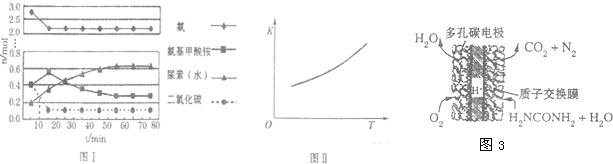
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平均总压强/KPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平均气体总浓度/10-3mol?L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目: 来源: 题型:
| X | Y | |
| Z | W |
查看答案和解析>>
科目: 来源: 题型:
 科学家利用淡水与海水之间含盐量的差别发明了一种新型电池-水电池.
科学家利用淡水与海水之间含盐量的差别发明了一种新型电池-水电池.查看答案和解析>>
科目: 来源: 题型:
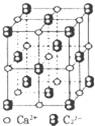 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.查看答案和解析>>
科目: 来源: 题型:
 如图是测定铝粉(含镁粉)的纯度的实验装置.所用的NaOH(足量)的物质的量浓度为4.5mol?L-1.不同时间电子天平的读数如下表所示:
如图是测定铝粉(含镁粉)的纯度的实验装置.所用的NaOH(足量)的物质的量浓度为4.5mol?L-1.不同时间电子天平的读数如下表所示:| 实验操作 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 0 | 120 |
| 烧杯+NaOH溶液+样品 | 0 | 135 |
| 1 | 134.5 | |
| 2 | 134.1 | |
| 3 | 133.8 | |
| 4 | 133.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com