
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
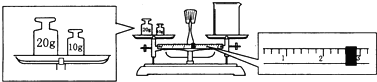 (1)选择提纯或分离的方法,将序号填在各项横线上.
(1)选择提纯或分离的方法,将序号填在各项横线上.查看答案和解析>>
科目: 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
| n(CO) |
n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
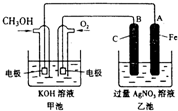 甲醇(CH3OH)是基本有机原料之一,是制造农药、医药、塑料、合成纤维及其他产品如甲醛、甲胺、氯甲烷、硫酸二甲酯等的原料.
甲醇(CH3OH)是基本有机原料之一,是制造农药、医药、塑料、合成纤维及其他产品如甲醛、甲胺、氯甲烷、硫酸二甲酯等的原料.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 物质 | 加入试剂 | 离子方程式 |
| NaCl(NaHCO3) | HCl | |
| K2CO3(KOH) | CO2 | |
| NaHCO3(Na2CO3) | CO2 |
查看答案和解析>>
科目: 来源: 题型:
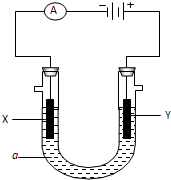 电解原理在化学工业中有广泛应用.如表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
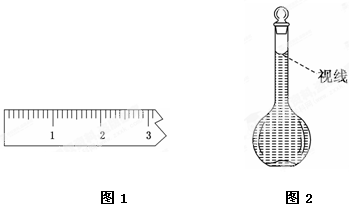
 (1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是
(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com