
科目: 来源: 题型:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
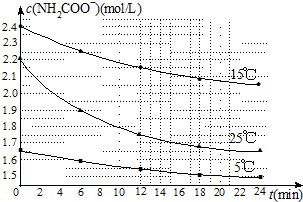
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:


| hv |
查看答案和解析>>
科目: 来源: 题型:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
| 3 |
| 2 |

查看答案和解析>>
科目: 来源: 题型:
 将0.1mol的铁铝混合物溶于100mL 2mol/L硫酸溶液中,然后再滴加1mol/LNaOH溶液.请回答:
将0.1mol的铁铝混合物溶于100mL 2mol/L硫酸溶液中,然后再滴加1mol/LNaOH溶液.请回答:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、Na+、Mg2+、Cl-、HCO3- |
| B、Mg2+、Al3+、NO3-、SO42- |
| C、K+、Cu2+、NO3-、SO42- |
| D、Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目: 来源: 题型:
A、SiO2+CaCO3
| ||||
B、3Mg+2NH3
| ||||
C、Fe3O4+4CO
| ||||
| D、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH |
查看答案和解析>>
科目: 来源: 题型:
| A、用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑ |
| B、氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O |
| C、用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O |
| D、硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O=H2SiO3↓+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com