
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ||
查看答案和解析>>
科目: 来源: 题型:
| +D |
| 一定条件 |
| +D |
| 一定条件 |
查看答案和解析>>
科目: 来源: 题型:
 前段时间席卷我国大部的雾霾天气给人们的生产生活带来了极大的影响,据统计我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、金属氧化物、有机颗粒物及扬尘等.
前段时间席卷我国大部的雾霾天气给人们的生产生活带来了极大的影响,据统计我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、金属氧化物、有机颗粒物及扬尘等. ,则该有机物核磁共振氢谱有
,则该有机物核磁共振氢谱有查看答案和解析>>
科目: 来源: 题型:
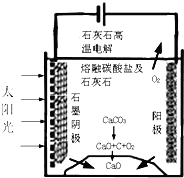 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.查看答案和解析>>
科目: 来源: 题型:
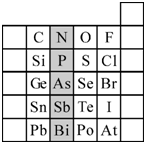 元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
科目: 来源: 题型:
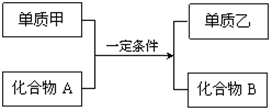 置换反应的通式可表示为如图:单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可表示为如图:单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
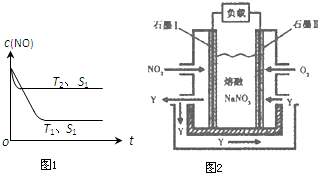 2013年12月杭州多日被雾霾笼罩,有报道称雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
2013年12月杭州多日被雾霾笼罩,有报道称雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目: 来源: 题型:
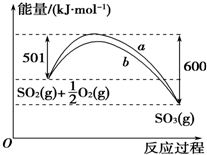 2013年我国煤炭产量35.2亿吨,约占一次能源生产总量78.6%;煤炭消费总量35.7亿吨,约占一次能源消费总量72.8%.中国富煤缺油少气的能源资源状况决定了在今后较长时期内,煤炭仍将是中国的主要能源.
2013年我国煤炭产量35.2亿吨,约占一次能源生产总量78.6%;煤炭消费总量35.7亿吨,约占一次能源消费总量72.8%.中国富煤缺油少气的能源资源状况决定了在今后较长时期内,煤炭仍将是中国的主要能源.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com