
科目: 来源: 题型:
| 甲 | 乙 | 丙 | |
| 所含元素 | C、H | C、H、F | C、H、F |
| 所含电子数 | 26 | ||
| 结构特点 | 饱和有机物 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 甲醇被称21世纪的新型燃料,工业上通过下列反应(Ⅰ)和(Ⅱ),用CH4和H2O为原料来制备甲醇.
甲醇被称21世纪的新型燃料,工业上通过下列反应(Ⅰ)和(Ⅱ),用CH4和H2O为原料来制备甲醇.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
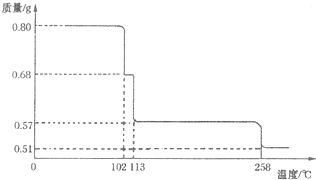 铜是一种与人类关系非常密切的有色金属.常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH 等.
铜是一种与人类关系非常密切的有色金属.常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH 等.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com