
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
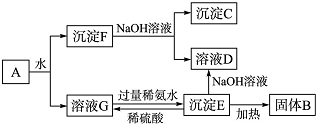 某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现图所示的变化.
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现图所示的变化.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
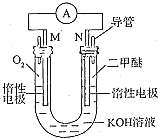 I.二甲醚是一种重要的新型清洁燃料j可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
I.二甲醚是一种重要的新型清洁燃料j可替代氟利昂作制冷剂,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
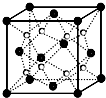 O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为
O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为查看答案和解析>>
科目: 来源: 题型:
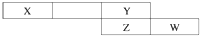 如图是从元素周期表中截取的一个片段,其中X、Y、Z、W均属于短周期元素.请回答下列问题.
如图是从元素周期表中截取的一个片段,其中X、Y、Z、W均属于短周期元素.请回答下列问题.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
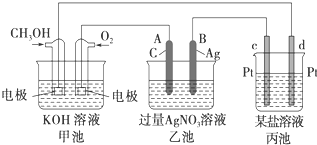
查看答案和解析>>
科目: 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
| O2 |
| O2 |
| H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com