
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
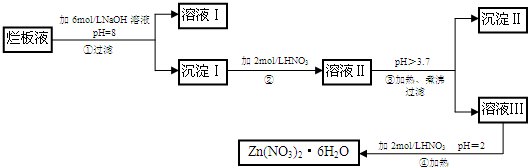
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 加入足量Na2CO3溶液 |
| 操作甲 |
| 加入足量A |
| 加热 |
| 趁热过滤 |
| 结晶操作 |
| 控制酸度 |
| FeSO4?7H2O |
| 晶体 |
| 温度/ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/ | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | |||||||

查看答案和解析>>
科目: 来源: 题型:
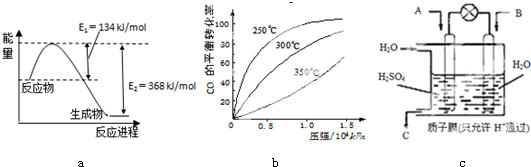
浓度/mol?L-1 时间/min |
NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com