
科目: 来源: 题型:
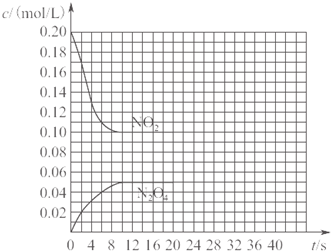 在30℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,经过10s达到平衡,浓度变化曲线如图所示.
在30℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,经过10s达到平衡,浓度变化曲线如图所示.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
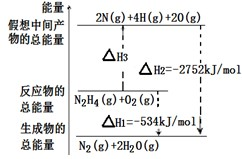
查看答案和解析>>
科目: 来源: 题型:
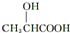 )有关的化学方程式:
)有关的化学方程式:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
科目: 来源: 题型:
| t1~t2 | t3~t4 | t4~t5 | t6~t7 |
| K1 | K2 | K3 | K4 |
| CO2%∽CO%~H2 (体积分数) |
0-30-70 | 2-28-70 | 4-26-70 | 8-22-70 | 20-10-70 | |||||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | |
| 碳转化率(%) | CHOH | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 | 8.0 | 12.0 | 22.6 |
| CH | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2.8 | 2.8 | 2.8 | |
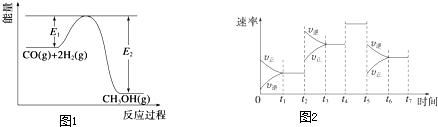
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
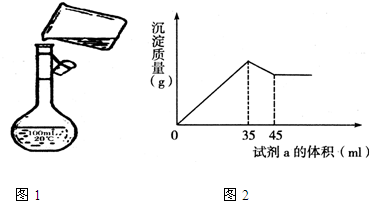
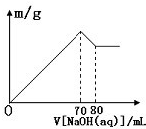 往100mL未知AlCl3和MgCl2的混合溶液中滴加入0.1mol/L的NaOH溶液,生产沉淀的质量随加入NaOH溶液体积的变化关系如图所示,求AlCl3和MgCl2的物质的量浓度.
往100mL未知AlCl3和MgCl2的混合溶液中滴加入0.1mol/L的NaOH溶液,生产沉淀的质量随加入NaOH溶液体积的变化关系如图所示,求AlCl3和MgCl2的物质的量浓度.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com