
科目: 来源: 题型:
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子数的2倍 |
| Y | Y原子基态时2p原子轨道上有3个未成对的电子 |
| Z | Z的基态原子最外层电子排布式为:nsnnpn+2 |
| W | W的原子序数为29 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 组别 | 第Ⅰ组 | 第Ⅱ组 | ||
| 被挑选出的单质 | ||||
| 挑选依据 | ||||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
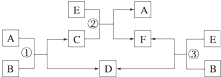 已知A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.试回答下列问题:
已知A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.试回答下列问题:查看答案和解析>>
科目: 来源: 题型:
1 1 |
2 1 |
13 6 |
14 6 |
14 7 |
56 26 |
56 26 |
16 8 |
16 8 |
1 1 |
2 1 |
3 1 |
A Z |
n b |
查看答案和解析>>
科目: 来源: 题型:
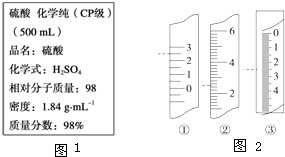 如图1是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
如图1是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol?L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
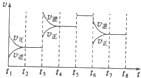 甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、髙效等优良的性能.
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、髙效等优良的性能.物质 | CH3OCH3(g) | H20(g) | |
| 浓度(mol?L-1) | 0.60 | 0.60 |
| 容器 | 甲2 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCO、4molH2 |
| CH3OH | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | a1 | a2 | a3 |
| t1-t2 | t4-t5 | t5-t6 | t7-t8 |
| K4 | K5 | K6 | K7 |
查看答案和解析>>
科目: 来源: 题型:
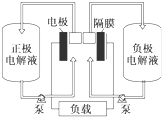 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.如图是钒电池基本工作原理示意图:回答下列问题:
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.如图是钒电池基本工作原理示意图:回答下列问题:+ 2 |
| 充电 |
| 放电 |
+ 2 |
+ 2 |
+ 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com