
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| 1 |
| 2 |
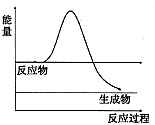
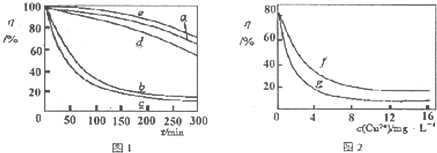
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验编号 | HA物质的量浓度 (mol/L) |
NaOH物质的量浓度 (mol/L) |
混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目: 来源: 题型:
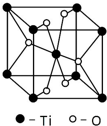 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目: 来源: 题型:
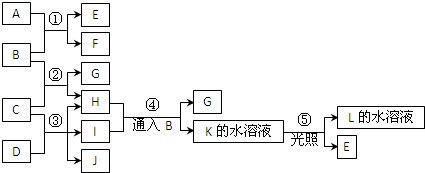
查看答案和解析>>
科目: 来源: 题型:
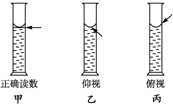 实验室用碳酸钠晶体配制1.00mol?L-1的Na2CO3溶液100mL,完成下列问题:
实验室用碳酸钠晶体配制1.00mol?L-1的Na2CO3溶液100mL,完成下列问题:查看答案和解析>>
科目: 来源: 题型:
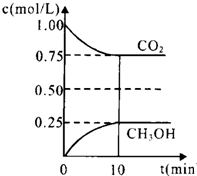 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目: 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 小苏打可用于治疗胃病 | NaHCO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可用作航天员的供氧剂 | Na2O2能和CO2、H2O反应生成O2 | Ⅰ对,Ⅱ对,无 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目: 来源: 题型:
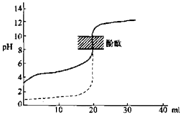 下列说法正确的是( )
下列说法正确的是( )| A、0.1 mol?L-1的Na2S溶液中c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| B、如图是用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和体积均相同的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C、HA是酸性略强与醋酸的弱酸,在0.1 mol?L-1 NaA溶液中,离子浓度关系可能是c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com