
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 3 |
| 4 |
| 1 |
| 2 |
| c(Al3+) | ||
c(
|
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
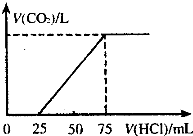 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡.使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡.使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
| 阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
| 浓度/mol?L-1 |
查看答案和解析>>
科目: 来源: 题型:
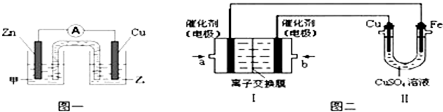
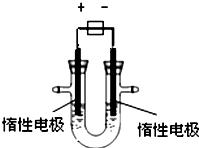 (1)用惰性电极电解CuSO4溶液(如图的装置),该过程中电解池电极反应式为是阳极:
(1)用惰性电极电解CuSO4溶液(如图的装置),该过程中电解池电极反应式为是阳极:查看答案和解析>>
科目: 来源: 题型:
| 起始n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
查看答案和解析>>
科目: 来源: 题型:
 |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol?Lˉ1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
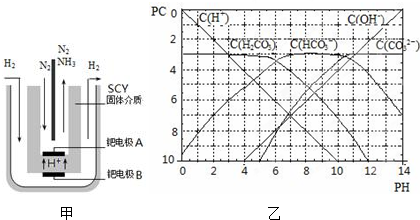
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com