
科目: 来源: 题型:
| A、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ | ||||
| B、Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | ||||
C、NH4HSO3液与足量NaOH溶液混合加热:NH4++HSO3-+2OH-
| ||||
| D、将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目: 来源: 题型:
| A、Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O |
| B、磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
| C、100mL 0.1mol/L FeI2溶液与标况下0.224L Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| D、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:
A、若完全燃烧,1mol雄酮( )比雌酮( )比雌酮( )多消耗3mol O2 )多消耗3mol O2 |
| B、正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 |
| C、蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 |
| D、乙醇依次通过消去、取代、加成反应可生成乙二醇 |
查看答案和解析>>
科目: 来源: 题型:
| A、向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体 |
| B、测定工业烧碱的含量(含杂质碳酸钠)可称取一定量样品放人锥形瓶中,加适量水溶解,再加入稍过量氯化钡溶液,用酚酞作指示剂,用标准浓度的盐酸滴定 |
| C、用分液漏斗分离苯与硝基苯 |
| D、除去氯化铁酸性溶液中的氯化亚铁:加入适量的过氧化氢水溶液 |
查看答案和解析>>
科目: 来源: 题型:

| A、在蒸发皿中灼烧CuSO4?5H2O晶体以除去结晶水 |
| B、配制0.1 mol?L-1硫酸溶液时,容量瓶应先用0.1 mol?L-1硫酸溶液润洗 |
| C、用图a所示装置实验,振荡后静置,溶液不再分层,且保持无色透明 |
| D、实验室用图b所示装置制取少量的氨气 |
查看答案和解析>>
科目: 来源: 题型:
| A、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| B、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、标准状况下,4.48L N2所含的共用电子对数0.2NA |
| D、常温下,1L 0.1mol?L-1的CH3COOH溶液中含有的H+数目为0.1NA |
查看答案和解析>>
科目: 来源: 题型:
| A、在硫酸铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| B、碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ |
| C、往FeCl3溶液中加入Fe粉:2Fe3++Fe═3Fe2+ |
| D、氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O |
查看答案和解析>>
科目: 来源: 题型:
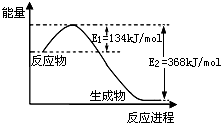
| 温度 | 平衡浓度/(mol L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
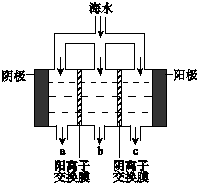 电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.
电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com