
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P l00kPa | 4 | 4.6 | 5.4 | 5.8 | 6 | 6 |
查看答案和解析>>
科目: 来源: 题型:
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) |
查看答案和解析>>
科目: 来源: 题型:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |


查看答案和解析>>
科目: 来源: 题型:
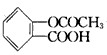 ,其分子式为
,其分子式为查看答案和解析>>
科目: 来源: 题型:
 二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答.
二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答.| 盐酸溶液体积/mL | 40.00 | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.200 | 10.80 | 14.40 | 21.60 |
| CO2质量/g | 3.080 | 4.620 | 3.520 | 0.880 |
查看答案和解析>>
科目: 来源: 题型:
| 族 周期 |
IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | Cl | Ar |
查看答案和解析>>
科目: 来源: 题型:

| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
查看答案和解析>>
科目: 来源: 题型:
| 180℃ |
| 催化剂 |
| CO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
| 浓度/mol?L-1/ 时间/min |
NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com