
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 如图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:
如图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:查看答案和解析>>
科目: 来源: 题型:
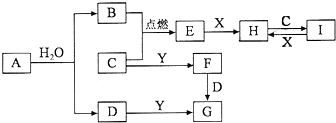 有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.
有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.查看答案和解析>>
科目: 来源: 题型:
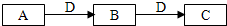 在一定条件下进行化学反应,请根据以下的转化关系回答下列问题,
在一定条件下进行化学反应,请根据以下的转化关系回答下列问题,查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿| 实验 序号 |
温度℃ | 初始CCl4浓度 (mol?L-1) |
初始H2浓度(mol?L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
查看答案和解析>>
科目: 来源: 题型:
物质的量比:x=
|
白色固体组成 | ||
| x>2 | NaOH和Na2CO3 | ||
| x=2 | |||
| 1<x<2 | |||
| x≤1 | NaHCO3 |
| V |
| N |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com