
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.
一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
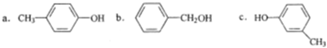
 和HOCH2CH2OH两种单体可通过
和HOCH2CH2OH两种单体可通过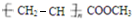
查看答案和解析>>
科目: 来源: 题型:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目: 来源: 题型:
| 选项 | 待区分的物质 | 所加试剂与操作方法 |
| A | 食盐和纯碱 | 食醋,观察有无气泡 |
| B | 金和黄铜 | 观察外观 |
| C | 棉和羊毛织物 | 取少量灼烧,闻气味 |
| D | PVC扣板和电玉 | 加热,观察是否熔化 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com