
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 每100g含有 营养成分 |
糖类 | 油脂 | 蛋白质 | 维生素C | 钙 | 镁 | 钠 | 锌 |
| 7.6g | 7.8g | 7.4g | 18mg | 201mg | 18.2mg | 30.8mg | 8.1mg |
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
查看答案和解析>>
科目: 来源: 题型:

| 剩余固体的物质 |
| 原始固体的物质 |
查看答案和解析>>
科目: 来源: 题型:
 科学研究发现Cu2O可作为太阳光分解水的催化剂.
科学研究发现Cu2O可作为太阳光分解水的催化剂.| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 物质 | SiCl4 | FeCl3 | PCl3 | PCl5 | AlCl3 |
| 熔点/℃ | -70 | 306 | -122 | 160°升华 | 178°升华 |
| 沸点/℃ | 57.6 | 315 | 76 | - | - |
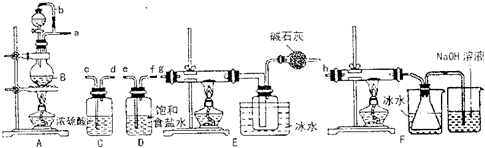
查看答案和解析>>
科目: 来源: 题型:
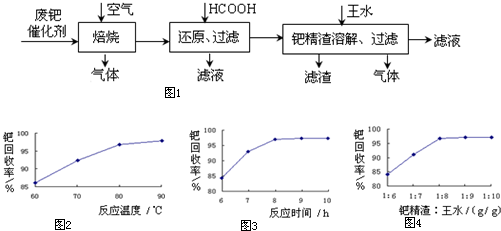
查看答案和解析>>
科目: 来源: 题型:
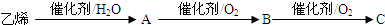
查看答案和解析>>
科目: 来源: 题型:
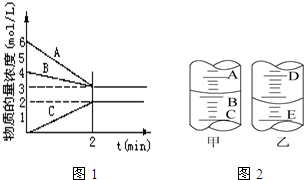 《化学反应原理》
《化学反应原理》查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com