
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 A是一种白色晶体,受热分解能生成B、C两种无色气体,C的水溶液与硝酸银溶液反应产生白色沉淀.A与浓NaOH溶液共热,放出无色气体B.若在圆底烧瓶中分别收集干燥的气体B和C,然后将收集满气体的烧瓶按如图所示装置组装,挤压滴管的胶头时,可以分别得到蓝色喷泉和红色喷泉.
A是一种白色晶体,受热分解能生成B、C两种无色气体,C的水溶液与硝酸银溶液反应产生白色沉淀.A与浓NaOH溶液共热,放出无色气体B.若在圆底烧瓶中分别收集干燥的气体B和C,然后将收集满气体的烧瓶按如图所示装置组装,挤压滴管的胶头时,可以分别得到蓝色喷泉和红色喷泉.查看答案和解析>>
科目: 来源: 题型:
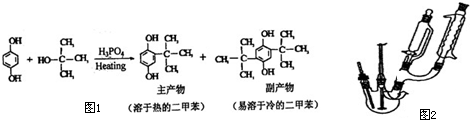
查看答案和解析>>
科目: 来源: 题型:
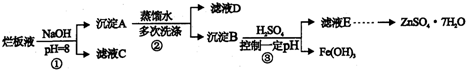
查看答案和解析>>
科目: 来源: 题型:
| ||
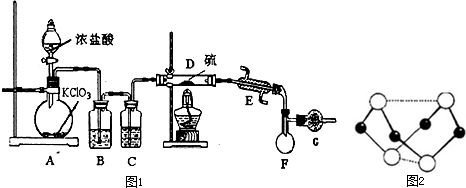
| ||
查看答案和解析>>
科目: 来源: 题型:

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀时的pH | 7.0 | 1.9 | 3.4 |
| 沉淀完全时的pH | 9.0 | 3.2 | 4.7 |
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏 | 得黄棕色溶液 | |
| 水,充分搅拌,静置,滤去沉淀. | ||
| 溶液中不含Fe2+ | ||
| 溶液中含有SO42- |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com