
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
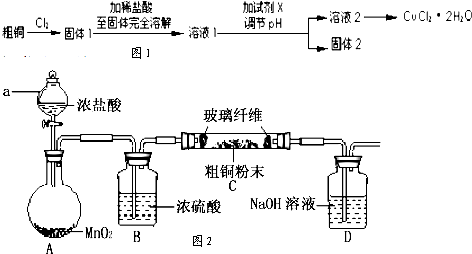
| 离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
2+ 4 |
2- 4 |
查看答案和解析>>
科目: 来源: 题型:
 1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于乙醇,熔点5.5℃,沸点267℃.1-萘酚(性质与苯酚相似)熔点96℃,沸点278℃,微溶于水,易溶于乙醇,乙醇的沸点为.5℃.1-乙氧基萘常用作香料,也可合成其他香料.实验室制备1-乙氧基萘的过程如下:
1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于乙醇,熔点5.5℃,沸点267℃.1-萘酚(性质与苯酚相似)熔点96℃,沸点278℃,微溶于水,易溶于乙醇,乙醇的沸点为.5℃.1-乙氧基萘常用作香料,也可合成其他香料.实验室制备1-乙氧基萘的过程如下: +C2H5OH
+C2H5OH| H2SO4 |
| △ |
 +H2O
+H2O| 实验目的 | 实验操作 | 预期现象和结论 |
| ①用金属钠检验1-乙氧基萘是否纯净 | 取少量经提纯的产品于试管A中,加入金属钠 | 若 若 |
| ②检验经提纯的产品是否含有1-萘酚 | 若 若 |
查看答案和解析>>
科目: 来源: 题型:
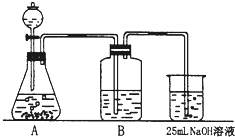 Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备.下面是他的实验过程.用50mL NaOH溶液吸收CO2气体制备Na2CO3.为了防止通入的CO2过量而生成NaHCO3,他设计了如下步骤:
Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备.下面是他的实验过程.用50mL NaOH溶液吸收CO2气体制备Na2CO3.为了防止通入的CO2过量而生成NaHCO3,他设计了如下步骤:查看答案和解析>>
科目: 来源: 题型:
 两组同学对碳酸钠和碳酸氢钠的混合物与酸的反应进行探究.
两组同学对碳酸钠和碳酸氢钠的混合物与酸的反应进行探究.
查看答案和解析>>
科目: 来源: 题型:

| 化学式 | 沉淀完全时的pH | 有关性质 |
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3?H2O=Co(OH)2↓+2NH4+ Co2++2H2O?Co(OH)2+2H+ Ni+2HCl=NiCl2+H2↑ Ni2++6NH3?H2O=[Ni(NH3)6]2++6H2O |
| Fe(OH)2 | 9.6 | |
| Fe(OH)3 | 3.7 |
| 加NH3?H2O调pH | 收率/% | Ni2+的含量/% |
| 9 | 98.1 | 0.08 |
| 9.5 | 98 | 0.05 |
| 10 | 97.6 | 0.005 |
| 10.3 | 94 | 0.005 |
查看答案和解析>>
科目: 来源: 题型:
| 族 周期 |
IA | 0 | |||||||
| 1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
| 2 | ② | ③ | Ne | ||||||
| 3 | ④ | ⑤ | Al | S | ⑥ | ||||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com