
科目: 来源: 题型:
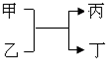 现有甲、乙、丙、丁4种物质,其转化关系如图:
现有甲、乙、丙、丁4种物质,其转化关系如图:查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
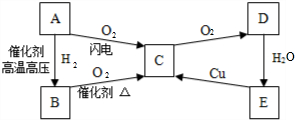
 下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如图所示的转化.
下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如图所示的转化.查看答案和解析>>
科目: 来源: 题型:
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少许样品于试管中,加 |
有无色气体产生,说明样品中含有Na2CO3. |
| ② | 有白色沉淀产生,则含Na2SO4 | |
| ③ |
查看答案和解析>>
科目: 来源: 题型:
 ,其分子中一定含有羧基(-COOH)和
,其分子中一定含有羧基(-COOH)和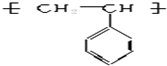 是一种重要的合成材料,契单体的结构简式为
是一种重要的合成材料,契单体的结构简式为
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
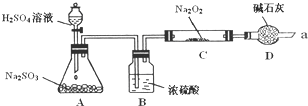 某同学想通过利用图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
某同学想通过利用图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com