
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ①加入NaOH溶液的体积(mL) | 5.0 | 7.5 | 10.7 | 12.0 | 12.3 | a | 12.8 | 13.0 | b | 17.5 | 20.0 |
| ②溶液pH | 1.3 | 1.5 | 2.0 | 2.6 | 3.0 | 7.0 | 11.2 | 11.4 | 12.0 | 12.4 | 12.5 |
| ③指示剂的颜色 | 无 | 无 | 无 | 无 | 无 | 粉红 | 红 | 红 | 红 | 红 | 红 |

查看答案和解析>>
科目: 来源: 题型:
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
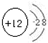 ,该离子的符号为
,该离子的符号为 所示,写出它的化学式
所示,写出它的化学式查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
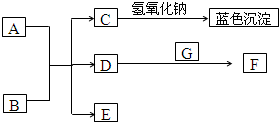 图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.常温下,A为紫红色金属固体,B为常见的强酸,G在空气中含量为21%的气态单质;D、F都是大气污染物,主要来源于汽车尾气,D为无色气体,F为红棕色气体.
图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.常温下,A为紫红色金属固体,B为常见的强酸,G在空气中含量为21%的气态单质;D、F都是大气污染物,主要来源于汽车尾气,D为无色气体,F为红棕色气体.查看答案和解析>>
科目: 来源: 题型:
 向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中XZ的物质的量浓度随时间变化的曲线.
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中XZ的物质的量浓度随时间变化的曲线.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com