
科目: 来源: 题型:
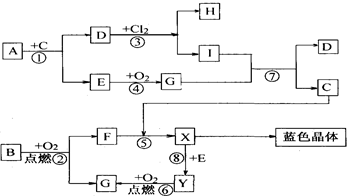 右图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体.
右图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体.查看答案和解析>>
科目: 来源: 题型:
| 操作 | ①往试管中滴入几滴 |
②继续滴入几滴新制氯水 |
| 现象 | 溶液无明显变化 | 溶液显红色 |
| 原因 | 溶液中没有Fe3+ | (用简要文字说明原因) |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
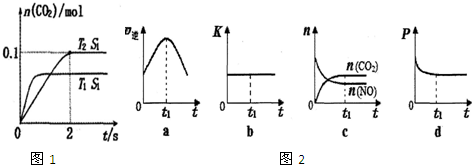
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
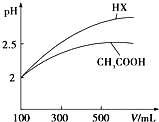 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com