
科目: 来源: 题型:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
| 800℃ |
| 800℃ |
| 800℃ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
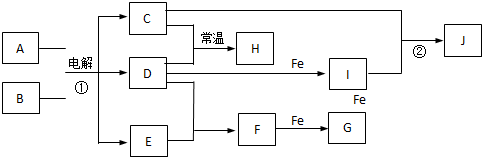
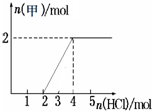 已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:| △ |
| △ |
| 高温 |
查看答案和解析>>
科目: 来源: 题型:
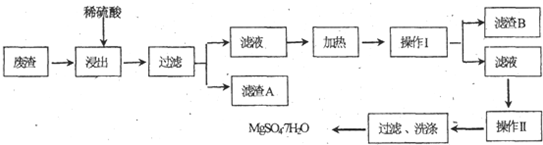
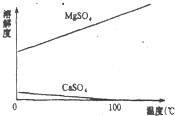
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 实验方法 | 实验现象 | 结论 |
| ①证明氯和溴单质的氧化性强弱 | |||
| ②证明溴和碘单质的氧化性强弱 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com