
科目: 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的pH | 3.7 | 5.2 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
| ||
查看答案和解析>>
科目: 来源: 题型:
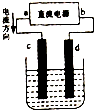 图是电解CuCl2溶液的装置,其中c、d为石墨电极.
图是电解CuCl2溶液的装置,其中c、d为石墨电极.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 黄铁矿(FeS2,其中S为-1价)是工业生产硫酸的重要原料.FeS2在高温下与氧气反应:3FeS2+8O2
黄铁矿(FeS2,其中S为-1价)是工业生产硫酸的重要原料.FeS2在高温下与氧气反应:3FeS2+8O2
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
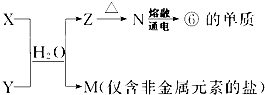
查看答案和解析>>
科目: 来源: 题型:
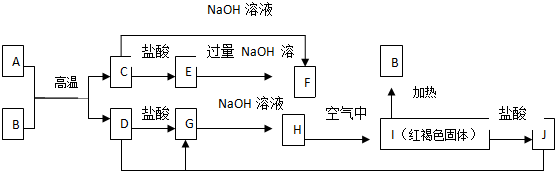
查看答案和解析>>
科目: 来源: 题型:
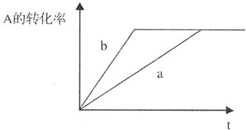 在一定条件下,可逆反应xA+yB?zC达到平衡.若:
在一定条件下,可逆反应xA+yB?zC达到平衡.若:查看答案和解析>>
科目: 来源: 题型:
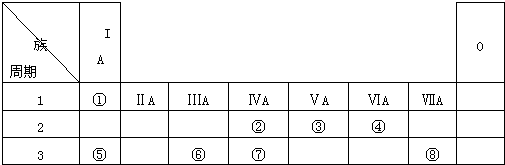
| 族 周期 |
IA | 0 | ||||||
| l | ① | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
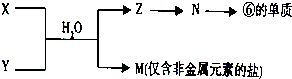
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
2- 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com