
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
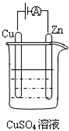 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)查看答案和解析>>
科目: 来源: 题型:
 工业制硝酸的主要反应为:
工业制硝酸的主要反应为:| 浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 时间 | |||
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
查看答案和解析>>
科目: 来源: 题型:
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
查看答案和解析>>
科目: 来源: 题型:
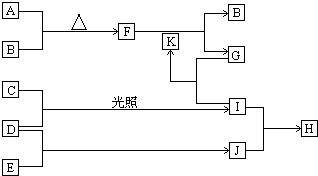 由五种短周期主族元素组成的单质及化合物(或其溶液),它们的转化关系如下图所示.其中,A、B、C、D、E为单质,常温下A为固体,B、C、D、E为气体;G为盐,其焰色反应为黄色;D和E的反应在工农业生产中有重要的意义;K为G和I反应的产物之一.
由五种短周期主族元素组成的单质及化合物(或其溶液),它们的转化关系如下图所示.其中,A、B、C、D、E为单质,常温下A为固体,B、C、D、E为气体;G为盐,其焰色反应为黄色;D和E的反应在工农业生产中有重要的意义;K为G和I反应的产物之一.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com