
科目: 来源: 题型:
| 组别 | 备选项 | 不同分类选项 | 挑选依据 |
| (1) | A.CO B.CO2 C.SO2 D.P2O5 | ||
| (2) | A.食盐水 B.浑浊的河水 C.带有飘尘的空气 D.二氧化碳气体 |
||
| (3) | A.CaO B.SO2 C.Na2O D.CuO | ||
(4) |
A.H2SO4B.H2CO3 C.NaH2PO4 D.HNO3 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
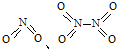 ,NO2中氮氧键的键能为466kJ?mol-1,N2O4中N-N键键能为167kJ?mol-1,氮氧键的键能为438.5kJ?mol-1,写出N2O4转化为NO2的热化学方程式
,NO2中氮氧键的键能为466kJ?mol-1,N2O4中N-N键键能为167kJ?mol-1,氮氧键的键能为438.5kJ?mol-1,写出N2O4转化为NO2的热化学方程式| 充电 |
| 放电 |
查看答案和解析>>
科目: 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分:查看答案和解析>>
科目: 来源: 题型:
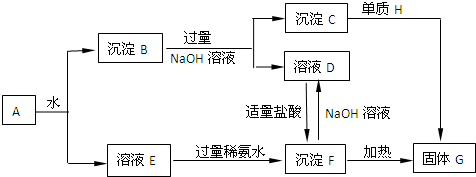
查看答案和解析>>
科目: 来源: 题型:


| 浓硫酸 |
| △ |
| 浓硫酸 |
| 140℃ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目: 来源: 题型:
 2016年奥运会将在里约热内卢举行,如图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成.A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3:4,电子数之比为3:2.
2016年奥运会将在里约热内卢举行,如图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成.A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3:4,电子数之比为3:2.查看答案和解析>>
科目: 来源: 题型:
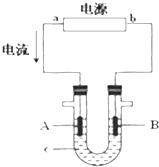 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:
 能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式
能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com