
科目: 来源: 题型:
 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,该电池利用质子交换膜传导H+,电池总反应为:2CH3OH+3O2=2CO2(g)+4H2O某化学兴趣小组同学研究甲醇-空气燃料电池原理,并进一步进行电化学实验,其实验装置示意图如图.
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,该电池利用质子交换膜传导H+,电池总反应为:2CH3OH+3O2=2CO2(g)+4H2O某化学兴趣小组同学研究甲醇-空气燃料电池原理,并进一步进行电化学实验,其实验装置示意图如图.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10-9 | 6.8×10-6 | 5.5×10-6 | 1.8×10-11 |
查看答案和解析>>
科目: 来源: 题型:
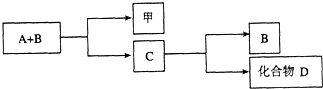 A、B、C是与生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质.它们之间有如图所示的转化关系:
A、B、C是与生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质.它们之间有如图所示的转化关系:| 点燃 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| H2O |
| O2 |

查看答案和解析>>
科目: 来源: 题型:
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | 原子最外层有3个未成对电子,次外层只有一对成对电子 |
| Z | Z存在质量数为27,中子数为14的核素 |
| W | +3价离子3d能级为半充满 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com