
科目: 来源: 题型:
 A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:
A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:查看答案和解析>>
科目: 来源: 题型:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

查看答案和解析>>
科目: 来源: 题型:
 我国工业上主要采用以下四种方法降低尾气中的含硫量:
我国工业上主要采用以下四种方法降低尾气中的含硫量:| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |
查看答案和解析>>
科目: 来源: 题型:

| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目: 来源: 题型:
| 原子或分子结构、单质或化合物相关信息 | |
| X | 含X元素的物质焰色反应为黄色 |
| Y | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得Y的单质 |
| Z | Z元素原子易失去2个电子形成8电子结构的离子 |
| M | M元素原子的最外层电子数是K层电子数的3倍,M与X处于同一周期 |
查看答案和解析>>
科目: 来源: 题型:
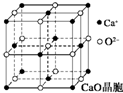 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C
| ||
| ||
2- 2 |
2- 2 |
2- 2 |
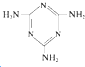 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(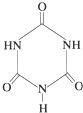 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com