
科目: 来源: 题型:
| H2CO3 | Ka1=4.3×10-7 | H2C2O4 | Ka1=5.6×10-2 |
| Ka2=5.6×10-11 | Ka2=5.42×10-5 |
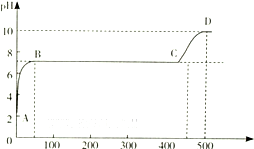
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | 消耗NaOH溶液的平均体积(mL) | |
| 滴定前 | 滴定后 | |||
| 1 | 20.00 | 0.00 | 16.26 | |
| 2 | 20.00 | 0.00 | 16.30 | |
| 3 | 20.00 | 0.02 | 16.24 | |
查看答案和解析>>
科目: 来源: 题型:
 乙醇汽油是一种由粮食及各种植物纤维加工成的燃料乙醇和普通汽油按一定比例混配形成的新型替代能源.按照我国的国家标准,乙醇汽油是用90%的普通汽油与10%的乙醇调和而成.
乙醇汽油是一种由粮食及各种植物纤维加工成的燃料乙醇和普通汽油按一定比例混配形成的新型替代能源.按照我国的国家标准,乙醇汽油是用90%的普通汽油与10%的乙醇调和而成.查看答案和解析>>
科目: 来源: 题型:
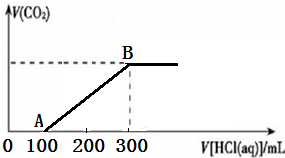 向200mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液.向上述所得溶液中,逐滴滴加2mol?L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
向200mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液.向上述所得溶液中,逐滴滴加2mol?L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:查看答案和解析>>
科目: 来源: 题型:
 某研究性学习小组用0.20mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:
某研究性学习小组用0.20mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:查看答案和解析>>
科目: 来源: 题型:
A、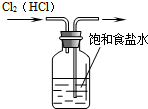 除去Cl2中的HCl杂质 |
B、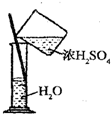 稀释浓硫酸 |
C、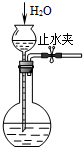 检查装置气密性 |
D、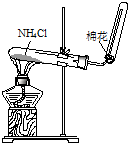 实验室制取NH3 |
查看答案和解析>>
科目: 来源: 题型:
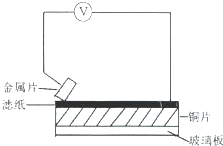 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A、Z金属可作为牺牲阳极保护法的阳极,保护Y金属 |
| B、Y金属不能从硫酸溶液中置换出氢气 |
| C、三种金属的活泼性顺序为:Z>X>Y |
| D、X和Y能构成电压最大的原电池 |
查看答案和解析>>
科目: 来源: 题型:

| A、铜作正极,发生氧化反应 |
| B、外电路中电子的移动方向为Fe→Cu |
| C、Fe电极的电极反应式为Fe-3e-═Fe3+ |
| D、盐桥中Cl-向正极移动 |
查看答案和解析>>
科目: 来源: 题型:
| A、钠与水反应 Na+H+=Na++H2 |
| B、用碳酸氢钠作为抗酸药来中和胃酸 H++HCO3-=H2O+CO2↑ |
| C、用熟石灰来中和酸性废水 Ca(OH)2+H+=Ca2++2H2O |
| D、用H2SO4来中和碱性废水 2H++2OH-=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com