
科目: 来源: 题型:
 牙膏的成分有活性物质、摩擦剂、甘油等物质.牙膏中的摩擦剂一般由CaC03、Al(OH)3、SiO2中的一种或几种物质组成.为探究某品牌牙膏中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适量牙膏样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现沉淀减少但仍有少量不溶物.为进一步探究牙膏中摩擦剂的成分,同学们进行了以下探究:
牙膏的成分有活性物质、摩擦剂、甘油等物质.牙膏中的摩擦剂一般由CaC03、Al(OH)3、SiO2中的一种或几种物质组成.为探究某品牌牙膏中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适量牙膏样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现沉淀减少但仍有少量不溶物.为进一步探究牙膏中摩擦剂的成分,同学们进行了以下探究:| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤. | |
| 步骤2:取适量沉淀于试管中, |
|
| 步骤3: |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
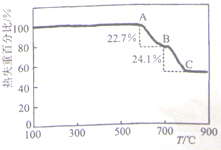 白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.
白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com