
科目: 来源: 题型:
 有一硝酸盐晶体,其化学式表示为M(NO3)x?nH2O经测定其摩尔质量为242g?mol-1.取1.21g该晶体溶于水配成100mL溶液.将此溶液倒入如图所示装置中,用石墨作电极进行电解.当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g.回答:
有一硝酸盐晶体,其化学式表示为M(NO3)x?nH2O经测定其摩尔质量为242g?mol-1.取1.21g该晶体溶于水配成100mL溶液.将此溶液倒入如图所示装置中,用石墨作电极进行电解.当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g.回答:查看答案和解析>>
科目: 来源: 题型:
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目: 来源: 题型:
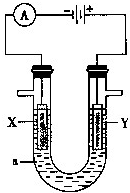 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
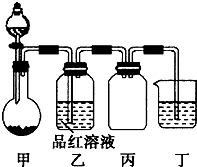 某化学兴趣小组在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究:
某化学兴趣小组在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究:
- 4 |
查看答案和解析>>
科目: 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目: 来源: 题型:

| 1 |
| 2 |
| 3 |
| 2 |

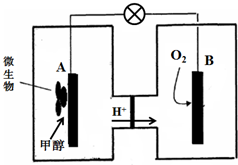
查看答案和解析>>
科目: 来源: 题型:
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 |
H2O | 0.01 mol?L-1 X 溶液 |
0.1 mol?L-1 双氧水 |
1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目: 来源: 题型:
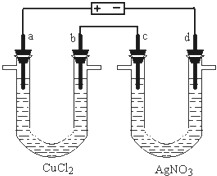 如图是一套电解装置,两U型管中均盛有50.0mL电解质溶液,a、b、c、d为 Pt电极.通电一段时间,d电极上析出金属Ag 2.16g,没有气体产生.同时在b、c两极收集到标准状况下相同体积的气体.请回答:
如图是一套电解装置,两U型管中均盛有50.0mL电解质溶液,a、b、c、d为 Pt电极.通电一段时间,d电极上析出金属Ag 2.16g,没有气体产生.同时在b、c两极收集到标准状况下相同体积的气体.请回答:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com