
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
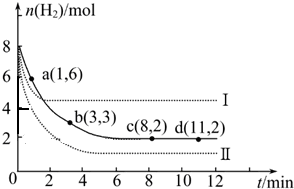
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
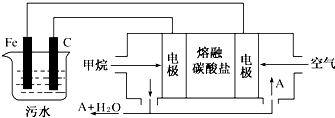
查看答案和解析>>
科目: 来源: 题型:
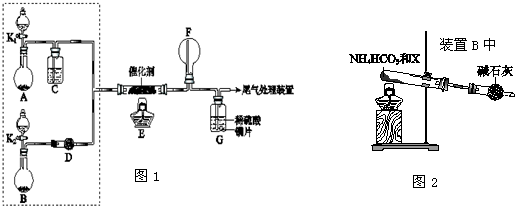
查看答案和解析>>
科目: 来源: 题型:
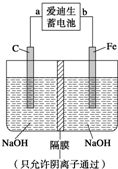 铁和铁的化合物用途广泛.请回答下列问题:
铁和铁的化合物用途广泛.请回答下列问题:| 放电 |
| 充电 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向苯酚浊液中加入Na2CO3溶液 | 溶液变澄清 | 酸性:苯酚>HCO3- |
| B | 向乙醇中加入浓H2SO4,加热,溶液变黑,将产生的气体通入酸性KMnO4溶液 | KMnO4溶液 褪色 |
该气体是乙烯 |
| C | 向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液X中无NH4+ |
| D | 用湿润的淀粉碘化钾试纸检验气体Y | 试纸变蓝 | 气体Y是Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com