
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 I.铁是人体必须的微量元素,绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成份.
I.铁是人体必须的微量元素,绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成份.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 Ⅰ化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一.
Ⅰ化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一.查看答案和解析>>
科目: 来源: 题型:
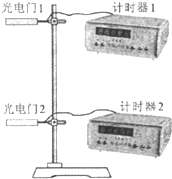 某实验小组采取如下步骤测定某苯酚样品的纯度.
某实验小组采取如下步骤测定某苯酚样品的纯度.2 3 |
2- 6 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 现有25℃时0.1mol?L-1的氨水和0.1mol?L-1的NaOH溶液,若向各20mL的氨水和NaOH溶液中分别滴加0.1mol?L-1的稀盐酸,滴定曲线如图所示,请回答以下问题.
现有25℃时0.1mol?L-1的氨水和0.1mol?L-1的NaOH溶液,若向各20mL的氨水和NaOH溶液中分别滴加0.1mol?L-1的稀盐酸,滴定曲线如图所示,请回答以下问题.查看答案和解析>>
科目: 来源: 题型:
| ||
查看答案和解析>>
科目: 来源: 题型:

| 实验操作 | 预期现象和结论 |
| 步骤一;取硬质玻璃管中固体产物少量分别与A、B试管中,加入足量1mol/L CuSO4溶液,搅拌溶解. |
(1)若A试管中黑色固体不溶解,并且没有观察到其它现象,则黑色固体为 (2)若B试管中有红色固体析出,则说明黑色固体中含有 |
| 步骤二:对试管B中溶液过滤,将所的固体洗涤干净后加足量1mol/L盐酸后再依次分别加入适量0.01mol/L氨水、少量0.01mol/L KSCN溶液. | ①若溶液不变红色,则 ②若溶液变红色,则 |
查看答案和解析>>
科目: 来源: 题型:
 反应A(g)+B(g)?c(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?c(g)+D(g)过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com