
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 颜色 | Ksp | |
| AgCl | 白色 | 1.8×10-10 mol2?L-2 |
| AgBr | 浅黄色 | 5.0×10-13 mol2?L-2 |
| AgI | 黄色 | 8.3×10-17 mol2?L-2 |
| Ag2CrO4 | 砖红色 | 1.1×10-12 mol3?L-3 |
| HgS | 黑色 | 1.6X10-52 mol2?L-2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
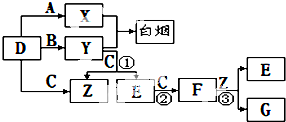 A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如下图所示(反应条件均已略去).请回答下列问题:
A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如下图所示(反应条件均已略去).请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
| 实验序号 | 铁的质量/g | 铁的形态 | c(H2SO4) /mol?L-1 |
V(H2SO4) /mL |
溶液温度 | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 铁片 | 0.7 | 50 | 20 | 36 | 250 |
| 2 | 0.10 | 铁片 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 铁粉 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 铁片 | 1.0 | 50 | 20 | 35 | 125 |
| 5 | 0.10 | 铁片 | 1.0 | 50 | 35 | 50 | 20 |
查看答案和解析>>
科目: 来源: 题型:
 大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验:
大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验:| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀,产生的气体(N)关系如图 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com