
科目: 来源: 题型:
| O | 2- 4 |
| H | + 4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
34 16 |
查看答案和解析>>
科目: 来源: 题型:
 I.将0.050molSO2和0.030molO2放入容积为1L的密闭容器A中;将0.100molSO2和0.060molO2放入容积为1L的密闭容器B中,反应:2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ?mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,则容器A中SO2的平衡转化率为
I.将0.050molSO2和0.030molO2放入容积为1L的密闭容器A中;将0.100molSO2和0.060molO2放入容积为1L的密闭容器B中,反应:2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ?mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,则容器A中SO2的平衡转化率为| 阳离子 | lgKMY | 阳离子 | lgKMY |
| Na+ | 1.66 | Mn2+ | 13.87 |
| Ca2+ | 10.96 | Pb2+ | 18.04 |
查看答案和解析>>
科目: 来源: 题型:
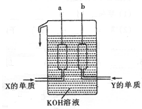 有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:查看答案和解析>>
科目: 来源: 题型:
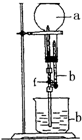 硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题:
硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题:查看答案和解析>>
科目: 来源: 题型:
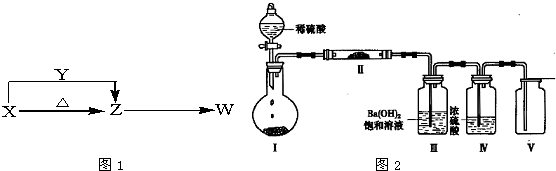
查看答案和解析>>
科目: 来源: 题型:
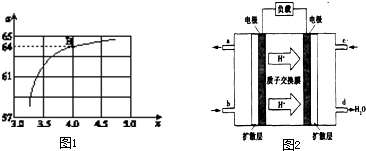
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| ||
| n(CO2) |
查看答案和解析>>
科目: 来源: 题型:
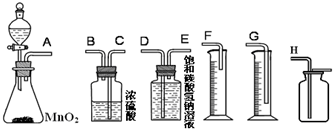
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有 |
若 若 若 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com