
科目: 来源: 题型:
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 判断依据 | 反应中有沉淀生成或溶解 | 反应中有颜色变化 | 反应中有气体生成 |
| A、CO32----------------气体法 |
| B、SO42------------------沉淀法 |
| C、H+--------------------显色法 |
| D、Cl---------------------气体法 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| CuO、CuCl2 |
| 400℃ |

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| O | - 3 |
| O | 2- 4 |
| O | 2- 3 |
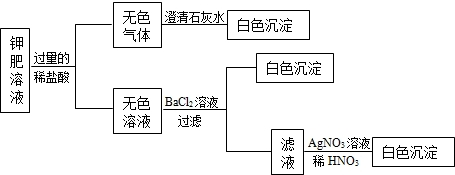
查看答案和解析>>
科目: 来源: 题型:
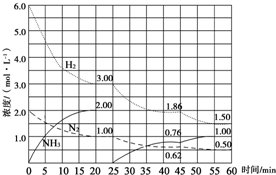 氨是最重要的氮肥,是产量最大的化工产品之一.
氨是最重要的氮肥,是产量最大的化工产品之一.| 催化剂 |
| 高温高压 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10?6mol) | 4.8 | 5.9 | 6.0 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com