
科目: 来源: 题型:
A、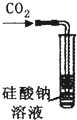 此装置:可用来证明碳的非金属性比硅强 |
B、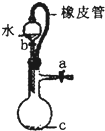 此装置:橡皮管的作用是平衡压强,使水顺利流下 |
C、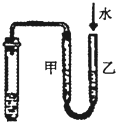 此装置:用图示的方法能检查此装置的气密性 |
D、 此装置:可收集二氧化碳或氨气 |
查看答案和解析>>
科目: 来源: 题型:
| A、饱和石灰水中加入生石灰,若保持温度不变,则溶液中Ca2+的物质的量不变 |
| B、升高饱和石灰水的温度时,Ca(OH)2溶度积常数Ksp减小 |
| C、饱和石灰水中加入生石灰,若保持温度不变,则pH不变 |
| D、向饱和石灰水中加入浓CaCl2溶液会有Ca(OH)2沉淀析出 |
查看答案和解析>>
科目: 来源: 题型:
| A、有大量的氯气泄漏时,用氢氧化钠溶液浸湿软布蒙面,并迅速离开现场 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、保存FeSO4溶液时,常加入少量铁屑 |
| D、少量的金属钠可以保存在CCl4中 |
查看答案和解析>>
科目: 来源: 题型:
| A、c (K+)>c (NO3-)>c (Ag+)>c (Cl-)>c (I-) |
| B、c (K+)>c (NO3-)>c (Cl-)>c (Ag+)>c (I-) |
| C、c (K+)>c (NO3-)>c (Ag+)=c (Cl-)+c (I-) |
| D、c (NO3-)>c (K+)>c (Ag+)>c (Cl-)>c (I-) |
查看答案和解析>>
科目: 来源: 题型:
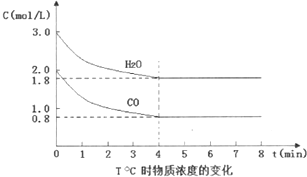 工业上利用CO和水蒸气在一定条件下发生反应制取氢气.
工业上利用CO和水蒸气在一定条件下发生反应制取氢气.| 温度/℃ | 500 | 600 | 850 |
| 平衡常数K | 10 | 9 | 1 |
| 容器编号 | 起始时各物质物质的量(单位:mol) | 达到平衡时H2的体积分数 | 结论 | |||
| CO | H2O | CO2 | H2 | |||
| 1 | 1 | 4 | 0 | 0 | ||
| 2 | 2 | 8 | 0 | 0 | ||
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
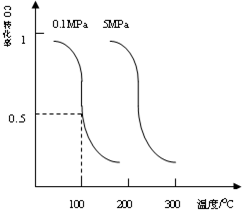 研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题.| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| t/min | CO(g)/(mol?L-1) | H2O(g)/(mol?L-1) | CO2(g)/(mol?L-1) | H2(g)/(mol?L-1) |
| 0 | 0.20 | 0.3 | 0 | 0 |
| 3 | 0.08 | 0.18 | c | c |
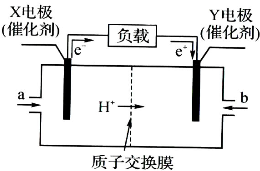
查看答案和解析>>
科目: 来源: 题型:
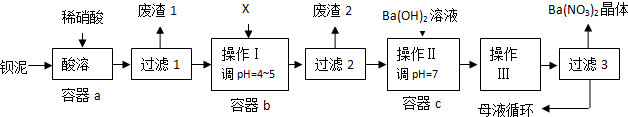
查看答案和解析>>
科目: 来源: 题型:
| A、向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B、AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C、温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D、将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI |
查看答案和解析>>
科目: 来源: 题型:
| A、某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| B、向某溶液中先滴加CaCl2溶液,产生白色沉淀,再滴加稀盐酸沉淀溶解并产生无色气体,该气体能使澄清石灰水变浑浊,则该溶液中一定有CO32- |
| C、液溴易挥发,存放液溴应加水封,并保存在棕色试剂瓶中 |
| D、向某溶液中先滴加BaCl2溶液,产生白色沉淀,再滴加稀盐酸白色沉淀不溶解,该溶液一定含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com