
科目: 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目: 来源: 题型:
| c(A) |
| c(B) |
| c(A) |
| c(B) |
| A、在该温度下,保持容积固定不变,向容器内补充了B气体,则a>b |
| B、保持温度、压强不变,充入惰性气体,则有a<b |
| C、若其他条件不变,升高温度,则有a<b |
| D、若a=b,容器中一定使用了催化剂 |
查看答案和解析>>
科目: 来源: 题型:
| A、11.2 L氧气中所含有的原子数为NA |
| B、常温常压下,48gO3含有的氧原子数为3NA |
| C、物质的量浓度为0.5 mol?L-1的MgCl2溶液中,含有Cl-个数为NA |
| D、C.1molMg与足量O2反应转移的电子数为NA |
查看答案和解析>>
科目: 来源: 题型:
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C、若单位时间内生成x molHCl的同时,生成x molH2,则反应达到平衡状态 |
| D、使用过量的H2或升高温度都可以提高SiCl4的转化率 |
查看答案和解析>>
科目: 来源: 题型:
| 催化剂 | 氯化铁 | 二氧化锰 | 猪肝 | 马铃薯 |
| 压强对时间的斜率 | 0.0605 | 3.8214 | 0.3981 | 0.0049 |
| H2O2 时间 FeCl36H2O |
1g | 2g | 3g |
| 3.0%(质量分数) 6.0%(质量分数) 9.0%(质量分数) |
445s 620s 790s |
135s 220s 300s |
110s 200s 230s |

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| O | - 4 |
| O | - 4 |
查看答案和解析>>
科目: 来源: 题型:
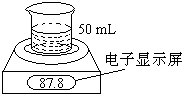 某学生用电子天平和必要的化学实验仪器测定铁铝合金中各组分含量,其实验装置如图所示:实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50mL 5.0mol?L-1 NaOH溶液的烧杯中.试回答下列问题:
某学生用电子天平和必要的化学实验仪器测定铁铝合金中各组分含量,其实验装置如图所示:实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50mL 5.0mol?L-1 NaOH溶液的烧杯中.试回答下列问题:| 实验操作过程 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 80.0 | |
| 烧杯+溶液+样品 | 0 | 87.8 |
| 1 | 87.5 | |
| 2 | 87.3 | |
| 3 | 87.2 | |
| 4 | 87.2 |
查看答案和解析>>
科目: 来源: 题型:
 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:| 时间/s | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com