
科目: 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目: 来源: 题型:
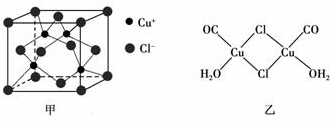
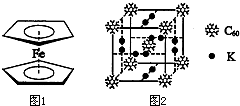
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上电子相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上电子相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:查看答案和解析>>
科目: 来源: 题型:
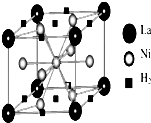 (1)目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.
(1)目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.| 139 |
| 57 |
| 放电 |
| 充电 |
查看答案和解析>>
科目: 来源: 题型:
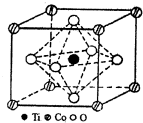 MnO2是碱锰电池材料中最普通的正极材料之一,在MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.| 元素 | Mn | Fe | |
| 电离能/kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目: 来源: 题型:
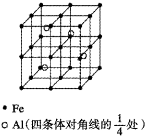 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu、Fe等.
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu、Fe等.| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com