
科目: 来源: 题型:
 已知A、B、C、D是单质,x、Y、z是化合物,它们之间有如下转化关系:
已知A、B、C、D是单质,x、Y、z是化合物,它们之间有如下转化关系:查看答案和解析>>
科目: 来源: 题型:
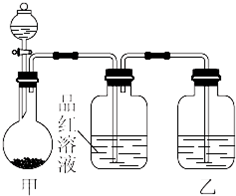 小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究.
小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究.| 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目: 来源: 题型:
 某化工厂以硫磺为原料生产硫酸.设空气中的氧气的体积分数为
某化工厂以硫磺为原料生产硫酸.设空气中的氧气的体积分数为查看答案和解析>>
科目: 来源: 题型:
 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) | ||
| I | 150 |
|
0.1 | ||
| II | 5 | ||||
| III | 350 | 5 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
| 15 |
| 16 |
| ||
| △ |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、1.0 mol/L的Fe(NO3)2溶液:H+、Na+、SCN-、S2- |
| B、c(OH-)/c(H+)=1013的溶液Mg2+、NH4+、MnO4-、Cl- |
| C、pH=l的溶液:K+、NH4+、NO3-、Cl- |
| D、能溶解Al2O3的溶液:Na+、K+、HCO3-、I- |
查看答案和解析>>
科目: 来源: 题型:
| A、常温常压下,22.4L NH3中含有3nA个N-H键 |
| B、0.5mol?L-1CuCl2溶液中含有nA个Cl- |
| C、1 molNO2溶于水后溶液中含有nA个NO3- |
| D、48gO3气体含有nA个O3分子 |
查看答案和解析>>
科目: 来源: 题型:

| A、实验I:制取并收集氢气 |
| B、实验II:验证葡萄糖的还原性 |
| C、实验III:实验室制氨气并收集干燥的氨气 |
| D、实验Ⅳ:检查碱式滴定管是否漏液 |
查看答案和解析>>
科目: 来源: 题型:
| A、15.6 g Na2O2与过量CO2反应时,转移电子数为0.4NA |
| B、5.6 g Fe与过量硫粉反应,转移电子数为0.3NA |
| C、3.1 g白磷与红磷的混合物中所含磷原子数为0.1NA |
| D、某温度时,pH=6的纯水中含10-6NA个OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com