
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
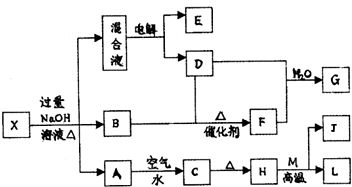
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
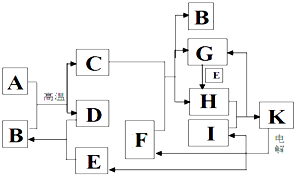
查看答案和解析>>
科目: 来源: 题型:
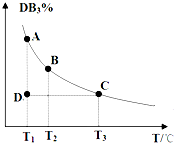 原子序数依次增大的A、B、C、D、E五种短周期元素,B、D同主族,A、B是同周期不相邻的两元素其原子的最外层电子数之比为2:3,C是自然界中含量最多的金属元素.
原子序数依次增大的A、B、C、D、E五种短周期元素,B、D同主族,A、B是同周期不相邻的两元素其原子的最外层电子数之比为2:3,C是自然界中含量最多的金属元素.| 催化剂 |
| 加热 |
| 5 |
| 6 |
查看答案和解析>>
科目: 来源: 题型:
| A、向Mg(HCO3)2溶液中加入过量的NaOH溶液Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | ||
| B、向NaOH溶液中通入过量的CO2气体:CO2+2OH-═CO32-+H2O | ||
| C、FeBr2 溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2 ═2Fe3++2Br2+6Cl- | ||
D、向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO
|
查看答案和解析>>
科目: 来源: 题型:
| A、2.0L 1.Omol?L-1 CH3COOH溶液中的H+离子数 | ||
| B、2.0L 1.0 mol?L-1CH3COONa溶液中的CH3COO-离子数 | ||
C、1.0L 1.0 mol?L-1NaHCO3溶液中的HCO
| ||
| D、1.0L 1.0 mol?L-1Na2CO3 溶液中的 C032-离子数 |
查看答案和解析>>
科目: 来源: 题型:
| 放电 |
| 充电 |
| A、放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 |
| B、充电时阴极反应为:Fe(OH)3-3e-+5 OH-═FeO42-+4H2O |
| C、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| D、充电时阳极附近溶液的碱性增强 |
查看答案和解析>>
科目: 来源: 题型:
| A、1 mol NaHSO4晶体中含有的离子总数为3NA |
| B、常温下,0.1mol/L Na2C03溶液中C032-的数目一定小于0.1NA |
| C、标准状况下,2.24LCH3Cl中含有的共用电子对数为O.4NA |
| D、用石墨作电极电解CuSO4溶液,当阳极产生2.24L标准状况下的气体时,流经溶液的电子数为0.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com