
科目: 来源: 题型:
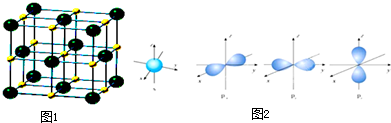
查看答案和解析>>
科目: 来源: 题型:
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度g/100gH2O | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| NaOH/H2O |
| NaOH/醇 |
| 加热 |
| 光照 |
| Br2 |
| NaOH/醇 |
| 加热 |
| 溴水 |
| NaOH/水 |
| 加热 |
| O2催化剂 |
| 加热 |
| O2催化剂 |
| 加热 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、平衡时,体系内含NO2为0.04mol?L-1 |
| B、平衡时,N2O4的转化率为60% |
| C、前2s,N2O4的平均反应速率为0.005mol?L-1?s-1 |
| D、在2s时,体系内压强为反应前的1.1倍 |
查看答案和解析>>
科目: 来源: 题型:
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C、向水中加入少量固体NaCl,平衡不移动,导电能力不变 |
| D、将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目: 来源: 题型:
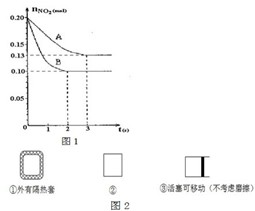 在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图1所示.
在容积为VL的密闭容器中发生2NO2?2NO+O2反应.反应过程中NO2的物质的量随时间变化的状况如图1所示.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com