
科目: 来源: 题型:
| A、铜铸塑像上出现铜绿[Cu2(OH2)CO3] |
| B、用石膏粉制作石膏雕像 |
| C、用铝质或铁质容器盛放浓硝酸 |
| D、酸雨的形成 |
查看答案和解析>>
科目: 来源: 题型:
| A、①中所得溶液中c(Cl-)-c(M+)=9.9×10-7mol/L |
| B、①c(H+)-c(MOH)=1×10-8mol/L |
| C、由②中信息知MOH的电离程度<M+的水解程度 |
| D、②中所得溶液中各离子浓度大小关系为:c(M+)>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:
| A、pH=0的溶液:Al3+、Mg2+、NO3-、I- | ||||
B、由水电离出的c(H+)=1×10-13mol/L的溶液:HCO
| ||||
C、含大量Fe3+的溶液:NH
| ||||
D、含大量HCO
 、Cl- 、Cl- |
查看答案和解析>>
科目: 来源: 题型:
A、向饱和NaHCO3溶液中通入过量SO2:SO2+HCO
| ||||
B、含等物质的量溶质的亚硫酸氢铵溶液和氢氧化钠溶液的反应:NH
| ||||
C、澄清石灰水与少量Ca(HCO3)2溶液混合:Ca2++2OH-+2HCO
| ||||
D、NH4Al(SO4)2溶液中加入过量Ba(OH)2溶液:Al3++2SO
|
查看答案和解析>>
科目: 来源: 题型:
 用右图表示的一些物质或概念之间的从属或包含关系中不正确的是( )
用右图表示的一些物质或概念之间的从属或包含关系中不正确的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 苯 | 芳香烃 | 有机化合物 |
| B | 溶液 | 分散系 | 混合物 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.
铬镀层光亮,坚硬,耐热,是优良的装饰性和保护性镀层,长期以来都以六价铬电镀工艺为主,这种工艺污染大,毒性高,我国的《电子信息产品污染控制管理办法》明确规定,从2007年3月1日起控制六价铬工艺的使用,改用三价铬的电镀工艺是研究的热点.某电解槽阴极是铜,阳极是惰性金属,电解液中含Cr2(SO4)3 0.45kg?L-1、体积 100L的水溶液.通电一段时间后,当通过的电子为56mol时,阴极铜增重0.338kg.- 4 |
查看答案和解析>>
科目: 来源: 题型:
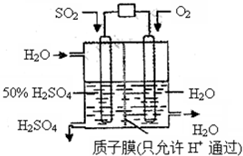 某研究组设想以如图所示装置用电化学原理生产硫酸.关于该装置的叙述正确的是( )
某研究组设想以如图所示装置用电化学原理生产硫酸.关于该装置的叙述正确的是( )| A、该装置为原电池,通入O2的电极是负极 |
| B、该装置中,通入SO2的电极的电极反应式为:SO2+O2-+H2O-2e-=2H++SO42- |
| C、该装置中,H+通过质子膜向左侧移动 |
| D、在标准状况下,理论上每消耗11.2L SO2,则可产生0.5mol H2SO4 |
查看答案和解析>>
科目: 来源: 题型:
| A、常温常压下,22.4L氖气含有NA个氖原子 |
| B、1molNa2O2固体跟足量CO2气体完全反应,转移NA个电子 |
| C、等质量的N2和CO所含分子数均为NA |
| D、1molCu和足量稀硝酸反应产生NA个NO分子 |
查看答案和解析>>
科目: 来源: 题型:
 如图是实验室硫酸试剂标签上的部分内容,据此判断
如图是实验室硫酸试剂标签上的部分内容,据此判断查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com