
科目: 来源: 题型:
| A、澄清的溶液中:Na+、K+、MnO4-、AlO2- | ||
| B、滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32- | ||
C、
| ||
| D、c(I-)=0.1 mol?L-1的溶液中:Na+、H+、ClO-、SO42- |
查看答案和解析>>
科目: 来源: 题型:
| A、1molCH3+含电子数为10NA | ||||
| B、质量均为7.8 g Na2S、Na2O2的固体中含有的阴离子数均为0.1NA | ||||
| C、标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中反应,转移的电子数均为0.1 NA | ||||
D、在反应S+2KNO3+3C
|
查看答案和解析>>
科目: 来源: 题型:
| A、MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ |
| B、小苏打溶液中加入足量的Ca(OH)2溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、用稀硝酸洗涤试管内壁银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
| D、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:
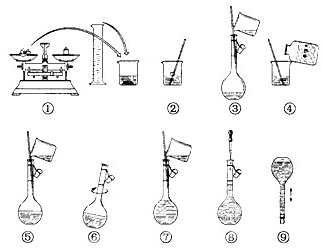 如图为配制250mL 0.2mol/L Na2CO3溶液的示意图.
如图为配制250mL 0.2mol/L Na2CO3溶液的示意图.查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
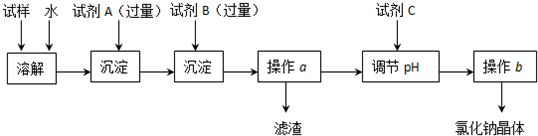

查看答案和解析>>
科目: 来源: 题型:
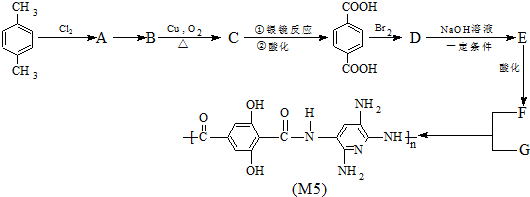
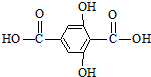
查看答案和解析>>
科目: 来源: 题型:

3+ 1-x |
| r | 3+ x |
查看答案和解析>>
科目: 来源: 题型:
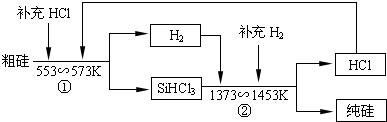
 I.飞机尾气中的NO会破坏臭氧层.利用催
I.飞机尾气中的NO会破坏臭氧层.利用催| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 1.20×10-3 | 124 | ||
| Ⅲ | 350 | 5.80×10-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com