
科目: 来源: 题型:
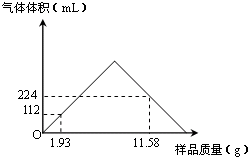 含钡化合物在实验室和工业生产中都有广泛的用途.
含钡化合物在实验室和工业生产中都有广泛的用途.| 500-520℃ |
| 1 |
| 9 |
查看答案和解析>>
科目: 来源: 题型:
| A、若将c1mol/L的醋酸冲稀10倍,则其pH增大1 |
| B、若将c2 mol/L的氢氧化钠溶液冲稀10倍,则其pH减小1 |
| C、若c1?v1=c2.v2,则混合液中c(CH3COO-)=c(Na+) |
| D、若混合液的pH=7,则混合液中c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目: 来源: 题型:
 [化学-物质结构与性质]
[化学-物质结构与性质]查看答案和解析>>
科目: 来源: 题型:
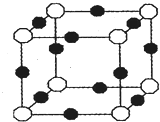 【物质结构与性质】
【物质结构与性质】查看答案和解析>>
科目: 来源: 题型:
A、CO2分子比例模型: | ||
B、S2-的结构示意图: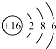 | ||
C、质子数为53,中子数为78的碘原子:
| ||
D、过氧化氢的电子式: |
查看答案和解析>>
科目: 来源: 题型:
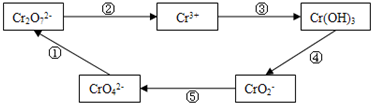
查看答案和解析>>
科目: 来源: 题型:
| A、常温常压下,4.4g CO2和4.4g N2O的原子总数都是0.3NA |
| B、次氯酸光照分解产生22.4mL气体(标准状况下),转移电子数为0.002NA |
| C、常温下,4.6g乙醇含有C-H键总数为0.6 NA |
| D、0.2 mol?L-1FeCl3溶液中含有Cl-总数为0.6NA |
查看答案和解析>>
科目: 来源: 题型:
| A、12.5gCH2═CHCl和12.5g[CH2-CHCl]n中含氯原子数均为0.2NA |
| B、18g2H2O和18g3H2O中含有的质子数均为10NA |
| C、23gNa与氧气完全反应,消耗氧气分子数一定为0.5NA |
| D、84g NaHCO3固定和106g Na2CO3固体中CO2-3的数目均为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com